Dr.ssa Paola Antonini, direttore scientifico Meditrial – IN COLLABORAZIONE CON MEDITRIAL.
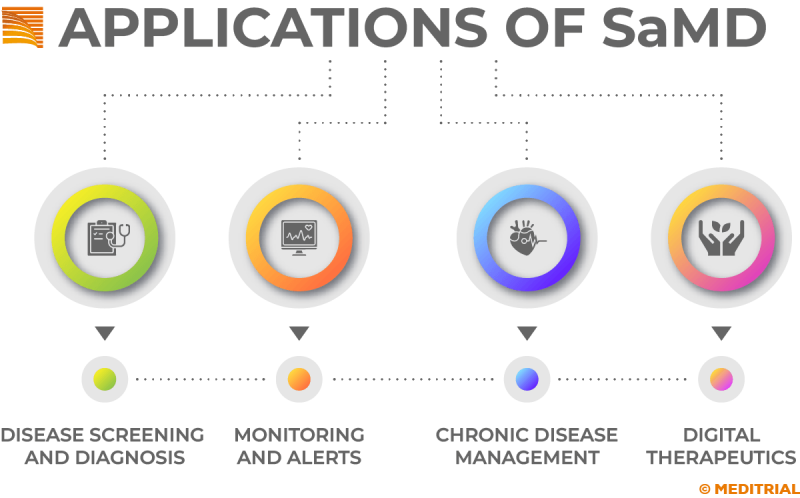
L’International medical device regulators forum (Imdrf), descrive i SaMD (Software as a Medical Device (SaMD) come software che possono funzionare su piattaforme informatiche generiche (non mediche). Possono essere utilizzati in combinazione con altri dispositivi medici o altro hardware/software. Il SaMD, che di per sé è un dispositivo medico, è uno dei tre tipi di software relativi ai dispositivi medici. Gli altri due tipi comprendono il software che è parte integrante di un dispositivo medico e quello utilizzato nella fabbricazione o nella manutenzione di un dispositivo medico. I SaMD rappresentano una rivoluzione nella tecnologia sanitaria digitale, in grado di svolgere funzioni mediche complesse, diagnosticare condizioni, indicare trattamenti e supportare la gestione clinica. L’uso del software come dispositivo medico è in continua crescita. I SaMD possono essere utilizzati per molti scopi, inclusi l’imaging ed il monitoraggio di specifiche funzioni o parametri medici, aiutando l’operatore sanitario nel percorso diagnostico-terapeutico.
SaMD: PANORAMA REGOLATORIO
Date le caratteristiche uniche del software come dispositivo medico, che vanno oltre quelle di un dispositivo medico o hardware tradizionale, le autorità regolatorie hanno riconosciuto la necessità di convergere su un quadro di principi comuni, che consenta a tutte le parti interessate di promuovere l’innovazione e proteggere la sicurezza dei pazienti. Nel 2013, l’IMDRF ha istituito il Software as a Medical Device Working Group (WG) per sviluppare linee guida a sostegno dell’innovazione e dell’accesso tempestivo a livello globale a SaMD sicuri ed efficaci. Presieduto dall’FDA, il gruppo di lavoro relativo al SaMD ha concordato:
- le definizioni chiave per i SaMD;
- il sistema di gestione della qualità da applicare ai SaMD;
- la valutazione clinica dei SaMD.
L’Imdrf Software as a medical device working group (WG) ha pubblicato quindi un quadro sulla classificazione del rischio dei SaMD (SaMD: Possible framework for risk categorization and corresponding considerations). Le raccomandazioni fornite in questo documento consentono ai produttori e alle autorità regolatorie di identificare più chiaramente le categorie di rischio del SaMD. Queste categorie si basano sui potenziali livelli di impatto che l’output del dispositivo può avere sul paziente o sulla salute pubblica. Il documento pubblicato da IMDRF classifica i SaMD in quattro differenti categorie di rischi.
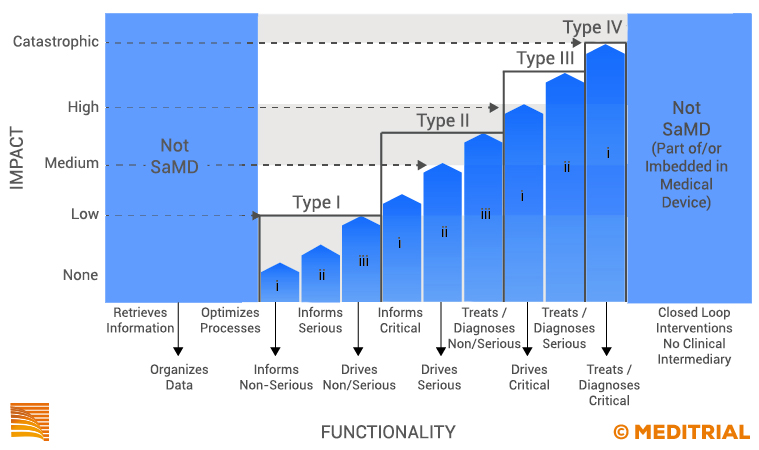
La classificazione del dispositivo è, dunque, strettamente correlata alla criticità delle informazioni fornite dal SaMD per trattare, diagnosticare, guidare o informare la procedura clinica. L’accuratezza di tali dati può risultare fondamentale per evitare effetti dannosi sulla salute. La categoria di Livello IV è il SaMD con il maggiore impatto sul paziente o sulla salute pubblica ed il Livello I è per l’impatto minore.
Un secondo documento pubblicato da Imdrf è relativo alla gestione della qualità dei SaMD (SaMD: Application of Quality management system). Tale documento aiuta i produttori e le autorità regolatorie internazionali a raggiungere una maggiore comprensione e un linguaggio comune per l’applicazione dei requisiti del sistema di gestione della qualità da applicare ai SaMD per tutto il loro ciclo di vita. Questo documento fornisce principi di gestione della qualità armonizzati, che l’Fda, insieme con altri enti regolatori, possono adottare nel rispetto dei propri quadri normativi.
Infine, è opportuno sottolineare come le decisioni sanitarie utilizzino sempre più sulle informazioni fornite dal SaMD. Per queste ragioni, L’Fda ha pubblicato la linea guida: SaMD: Clinical evaluation – Guidance for Industry and Food and drug administration staff per descrivere i principi e gli approcci da adottare nell’indagine clinica volta a dimostrare la sicurezza, l’efficacia e le prestazioni del software come dispositivo medico. La guida si concentra sulle attività che i produttori di SaMD devono intraprendere per un’adeguata valutazione clinica del loro software come dispositivo medico.

L’intelligenza artificiale (Artificial Intelligence-AI) è stata definita come la scienza per realizzare macchine intelligenti. L’intelligenza artificiale può utilizzare diverse tecniche, come modelli basati sull’analisi statistica dei dati, sistemi evoluti che si basano principalmente su relazioni “if-then” e macchine di apprendimento automatico (Machine learning-ML).
L’apprendimento automatico è una tecnica di intelligenza artificiale che è utilizzata per progettare algoritmi destinati ad apprendere e agire sui dati ricevuti. Gli sviluppatori di software possono utilizzare l’apprendimento automatico per creare algoritmi “Locked”, la cui funzione non cambia nel tempo, o “Adaptive” in modo che il loro comportamento cambi in base ai nuovi dati.
Alcuni esempi di intelligenza artificiale e tecnologie di apprendimento automatico includono per esempio un sistema di imaging che utilizza algoritmi per fornire informazioni diagnostiche.

La tecnologia è entrata quindi a pieno diritto in ogni aspetto del sistema sanitario permettendone un rapido sviluppo. I software che incorporano l’intelligenza artificiale e in particolare il sottoinsieme dell’AI noto come machine learning, sono diventati parte rilevante per numero crescente di dispositivi medici.
Uno dei maggiori vantaggi dell’uso delle AI/ML nel software risiede nella capacità di apprendere dall’uso e dall’esperienza del mondo reale e di migliorare progressivamente le prestazioni. Le nuove informazioni ottenute dai SaMD che utilizzano AI/ML, possono dunque rappresentare un fondamentale supporto diagnostico terapeutico.
Negli ultimi dieci anni, l’Fda ha esaminato ed autorizzato un numero crescente di dispositivi che incorporano AI/ML, con applicazioni in diversi campi della medicina. L’interesse per i dispositivi medici che incorporano la funzionalità di ML è dunque aumentato e ci si aspetta che questa tendenza continui.

PRINCIPI GUIDA FDA SUI SaMD
L’impiego dell’AI e delle ML porta con sé alcune questioni, come la necessità di monitorare, identificare e gestire continuamente i rischi associati a tali tecnologie, oltre che implicazioni inerenti la sicurezza, la privacy e l’etica.
Con lo scopo di affrontare queste problematiche, nel 2021, l’Fda insieme con l’Health Canada e l’Agenzia regolatoria del Regno Unito (Mhra), ha identificato congiuntamente 10 principi guida (Good machine learning practice for medical device development) per incoraggiare e promuovere lo sviluppo di dispositivi medici sicuri, efficaci e di alta qualità che utilizzano AI e ML.
Le 10 linee guida della Fda coprono una varietà di questioni, ma molte di esse ruotano intorno al modello di sviluppo della tecnologia, ai requisiti relativi alla sicurezza informatica (cybersecurity) e alla riduzione dei rischi, come anche alla necessità di coinvolgere il più ambio numero di esperti nello sviluppo e nella manutenzione di SaMD che si basano sull’AI e ML.
Questi principi possono aiutare i sistemi sanitari che ora si affidano a dispositivi medici AI/ML a comprendere e gestire al meglio le aree di criticità, nonché le startup di salute digitale e le imprese di biotecnologia a sviluppare dispositivi medici AI/ML sicuri, efficaci e di alta qualità.
I principi guida si pongono come obiettivo primario lo sviluppo di buone pratiche per lo sviluppo di tecnologie AI/ML. Tuttavia Il compito più impegnativo per le autorità regolatorie e per l’industria sarà lo sviluppo di politiche e procedure mirate che vadano ad integrarsi pienamente con le normative di qualità già esistenti.

IL MODELLO BASE DEI SaMD
I dispositivi medici basati su AI/ML hanno come modello base un programma o un algoritmo che si costruisce e si perfeziona attraverso la raccolta di un’ampia quantità di dati. Il modello fa previsioni basate sui dati raccolti. Se le previsioni sono corrette, il modello apprende e si rafforza mentre se è errato si regola per aumentarne la precisione. Questo processo di apprendimento richiede tempo e milioni o miliardi di correzioni. Più il modello viene raffinato, meglio riesce a fare diagnosi corrette e a ridurre il numero di quelle errate.
I 10 principi guida della Fda aiutano a garantire che gli algoritmi selezionati per il modello siano quelli più adatti alle caratteristiche dei dati raccolti e che i parametri siano adeguatamente modificati per produrre i risultati attesi.
La Fda raccomanda che i dati raccolti per il modello siano rappresentativi della popolazione di pazienti prevista, che il modello faccia riferimento a dati clinicamente rilevanti e che i campioni siano sufficientemente ampi e di qualità sufficiente per consentire agli esperti di ottenere informazioni dettagliate ed accurate. Tutto ciò richiede la partecipazione attiva di vari esperti con competenza multidisciplinare a garanzia che il modello sia sufficientemente robusto.
Le linee guida della Fda sottolinea l’importanza di implementare solide pratiche di sicurezza informatica, ponendo attenzione ai “fondamenti”, comprese le pratiche di ingegneria del software di base.
I test dovrebbero verificare le prestazioni del dispositivo in condizioni clinicamente rilevanti e questo richiede un piano di test statisticamente valido per garantire che la qualità dei dati sia integra e completa. L’autenticità e l’integrità dei dati devono essere garantite, non solo durante il processo di progettazione, ma anche dopo l’implementazione dei dispositivi. Infatti, il continuo monitoraggio del dispositivo nel mondo reale può migliorare la sicurezza e le prestazioni e ridurre bias e rischi.
SVILUPPO DEI SaMD NEL SETTORE SANITARIO
L’implementazione dell’AI/ML nel settore sanitario non è di facile attuazione, richiede un investimento significativo e la collaborazione di un ampio numero di stakeholders ed esperti, che potrebbe richiedere formazione continua sia degli operatori sanitari che dei pazienti che utilizzano tali dispositivi. Tuttavia il risultato nell’uso di queste tecnologie non può che portare ad un migliore monitoraggio dello stato clinico del paziente.
L’intelligenza artificiale e le tecnologie di apprendimento automatico hanno il potenziale per trasformare l’assistenza sanitaria, traendo nuove e importanti intuizioni dalla grande quantità di dati generati durante l’erogazione dell’assistenza sanitaria quotidiana. I produttori di dispositivi medici stanno già utilizzando queste tecnologie per innovare i loro prodotti, per assistere gli operatori sanitari e migliorare l’assistenza ai pazienti.
Gli studi sulle prestazioni cliniche devono sempre essere progettati in modo da specificare le evidenze cliniche che lo studio intende produrre tenendo conto dei potenziali rischi, dei requisiti etici appropriati e garantendo la conformità a tutti i requisiti legali e normativi applicabili.
Attraverso il Piano di studio delle prestazioni cliniche (CPSP) vengono definiti i criteri, gli obiettivi, la progettazione, l’analisi proposta, la metodologia, la condotta di monitoraggio e la registrazione dello studio della prestazione clinica (allegato XIII IVDR 2.3.2).
Gli studi sulle prestazioni cliniche devono sempre essere progettati in modo da specificare le evidenze cliniche che lo studio intende generare tenendo conto dei potenziali rischi, dei requisiti etici appropriati e garantendo la conformità a tutti i requisiti legali e normativi applicabili. Poiché gli studi sulla prestazione clinica devono essere adattati alla popolazione prevista specificata, il fabbricante deve valutare e giustificare l’uso di qualsiasi campione all’interno del proprio studio sulla prestazione in considerazione dello scopo previsto e del tipo di IVD. La sostanziale differenza tra il mondo dei dispositivi medici e dei dispositivi medico diagnostici in vitro è rappresentata dal concetto di “prestazione clinica” presente soltanto in questi ultimi. La prestazione clinica di un diagnostico in vitro è la sua abilità a produrre risultati strettamente correlati con una particolare condizione clinica, psicologica o patologica in funzione della sua destinazione d’uso (la capacità di un test rilevare la positività/negatività di un paziente).
Dr.ssa Paola Antonini, direttore scientifico Meditrial – IN COLLABORAZIONE CON MEDITRIAL.








Leave A Comment