Dr.ssa Paola Antonini, direttore scientifico Meditrial
Negli ultimi anni il settore dei biomarker nella ricerca e nella pratica clinica ha presentato notevoli progressi. Questi test possono essere utilizzati nello screening, nella diagnosi, nella caratterizzazione e nel monitoraggio delle malattie; come indicatori prognostici; per lo sviluppo di interventi terapeutici individualizzati; per la previsione e il trattamento delle reazioni avverse ai farmaci; per identificare i tipi cellulari; e per studi farmacodinamici e dose-risposta. L’uso di biomarcatori clinici è più facile e meno costoso della misurazione diretta dell’endpoint clinico finale e i biomarcatori vengono generalmente misurati in un arco di tempo più breve. Per comprendere il valore di un biomarcatore, è necessario conoscere la relazione fisiopatologica tra il biomarcatore e l’endpoint clinico rilevante.
L’identificazione di biomarker affidabili può contribuire fortemente allo sviluppo di nuove terapie ed aumentare le percentuali di successo degli studi clinici. Con il passaggio ad un modello di studio più personalizzato, è possibile progettare protocolli dedicati unicamente ai pazienti con maggiori probabilità di rispondere al trattamento. Nella pratica clinica, questo approccio consente di fornire cure personalizzate, più sicure ed efficaci.
Questo articolo illustra le ultime innovazioni del settore e le ragioni per cui i biomarker saranno sempre più rilevanti nello sviluppo di nuove terapie.
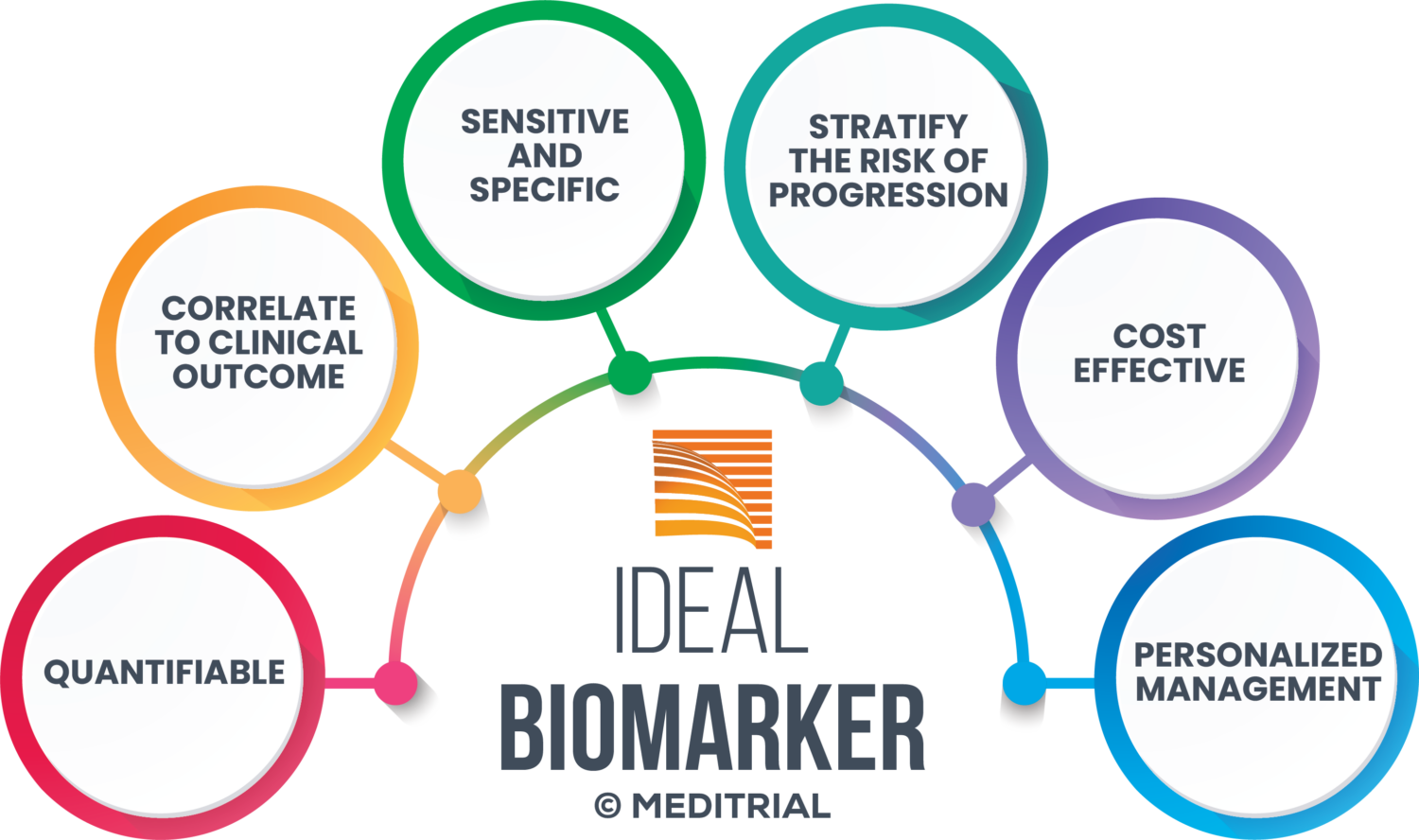
TIPOLOGIE DI BIOMARKER
L’FDA definisce il biomarker come una caratteristica definita e misurabile dei normali processi biologici o patologici o della risposta ad intervento terapeutico. È possibile distinguere biomarker di sicurezza e di efficacia.

I biomarker possono essere costituiti da DNA, RNA, proteine, metaboliti misurati da campioni di sangue, urina o saliva, liquidi biologici e da tessuti come anche le masse tumorali. Mentre i biomarker quantitativi forniscono valori distribuiti su una scala continua, alcuni biomarker di natura qualitativa fornisco un risultato binario (presente o assente). La distinzione tra individui positivi ai biomarker e negativi ai biomarker è effettuata sulla base di un valore di soglia (o cut-off) applicato alle misurazioni quantitative, che spesso è determinato attraverso studi su campioni analizzati retrospettivamente.
CLASSIFICAZIONE DEI BIOMARKER
Di seguito viene fornita una classificazione dei biomarker:
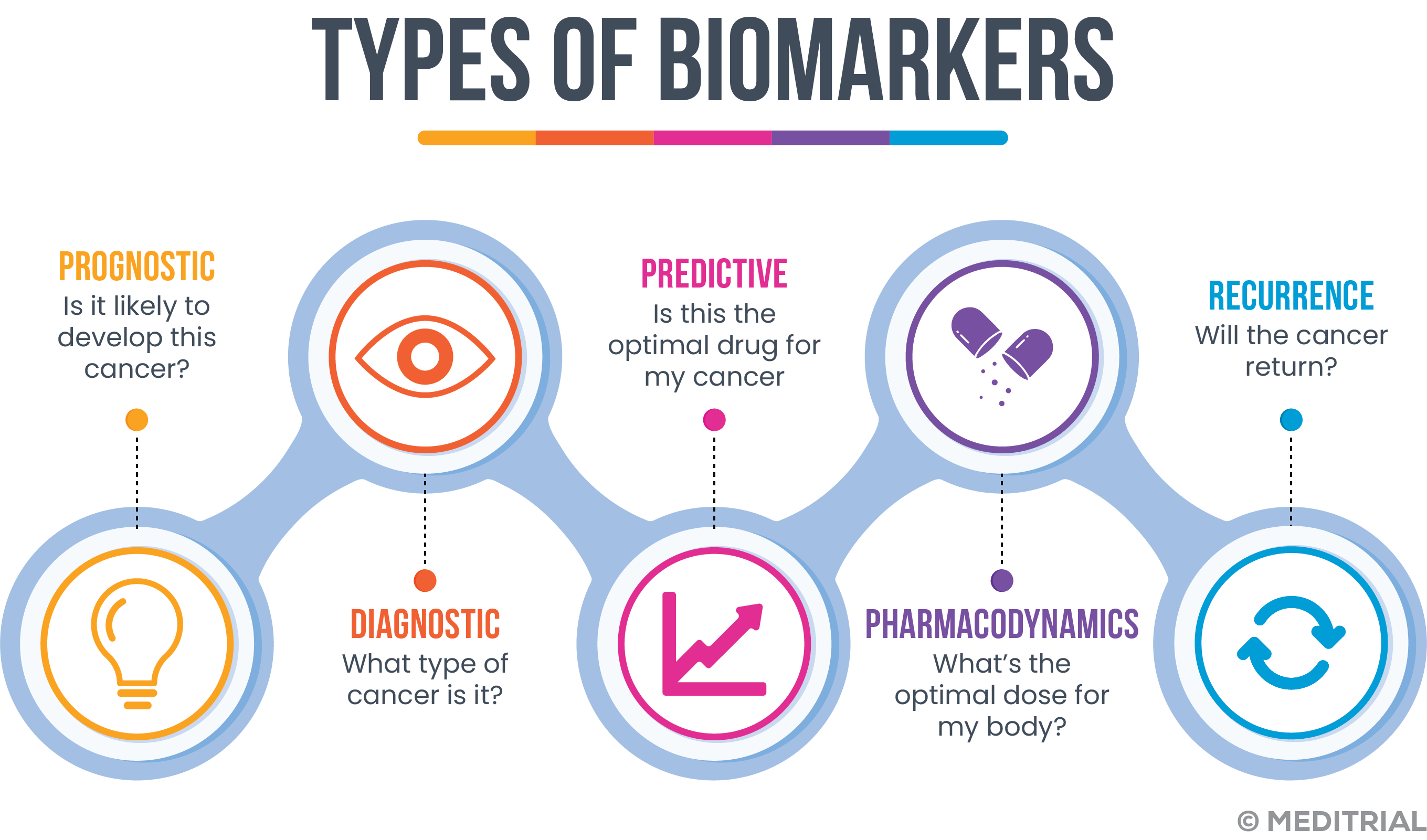
- Biomarker prognostici: un biomarker è definito prognostico quando è in grado di fornire informazioni sulla storia della malattia, indipendentemente dalle terapie che il paziente riceve. I biomarker prognostici sono in grado di indicare il probabile esito di una malattia, in assenza di un intervento terapeutico. Può essere usato come strategia di arricchimento (Enriched Clinical Trials) per selezionare i pazienti che potrebbero avere risultati clinici interessanti o progredire rapidamente.
- Biomarker predittivo: un biomarker è predittivo quando fornisce informazioni sull’attività di specifiche terapie consentendo, quindi, di stratificare i pazienti in base alla loro probabilità o meno di rispondere a un determinato trattamento. Anche questi marcatori possono essere impiegati come strategia di arricchimento degli studi clinici, per identificare una sottopopolazione che potrebbe avere una risposta favorevole o sfavorevole ad un trattamento.
- Biomarker farmacodinamici: questi biomarker aiutano a determinare gli effetti farmacologici di un farmaco e possono fornire indicazione sull’efficacia del trattamento. La maggior parte dei biomarker farmacodinamici, è principalmente impiegato durante gli studi di fase II per comprendere meglio come impiegare un farmaco e guidare nella scelta della dose (Proof-of-concept e dose-ranging studies). Difficilmente vengono impiegati come base per l’approvazione regolatoria.
APPLICAZIONE DEI BIOMARKER NEI TRIAL CLINICI
L’efficienza di un trial clinico può essere fortemente favorita da un protocollo che utilizza biomarker per stratificare i pazienti durante l’arruolamento o per monitorare la risposta al trattamento. I biomarker migliorano inoltre la selezione dei pazienti per una determinata sperimentazione clinica, permettendo la riduzione del campione.
Un vantaggio fornito dai biomarker è l’ottimizzazione dello studio clinico, identificando i pazienti che hanno una maggiore probabilità di ottenere benefici da un particolare prodotto ed escludendo nel contempo i pazienti che possono avere un maggiore rischio di sviluppare reazioni avverse. Quest’ultimo aspetto ha importanti implicazioni etiche e sociali. Pazienti negativi al biomarker di riferimento potrebbero essere esclusi da studi con trattamenti per loro inefficaci o non sicuri.
IL DISEGNO DEGLI STUDI BASATI SUI BIOMARKER
Esistono diverse tipologie di studi clinici basati sui biomarker, tra cui studi clinici che prevedono lo sviluppo combinato del farmaco e del relativo biomarker (companion diagnostics) nel contesto della medicina di precisione.

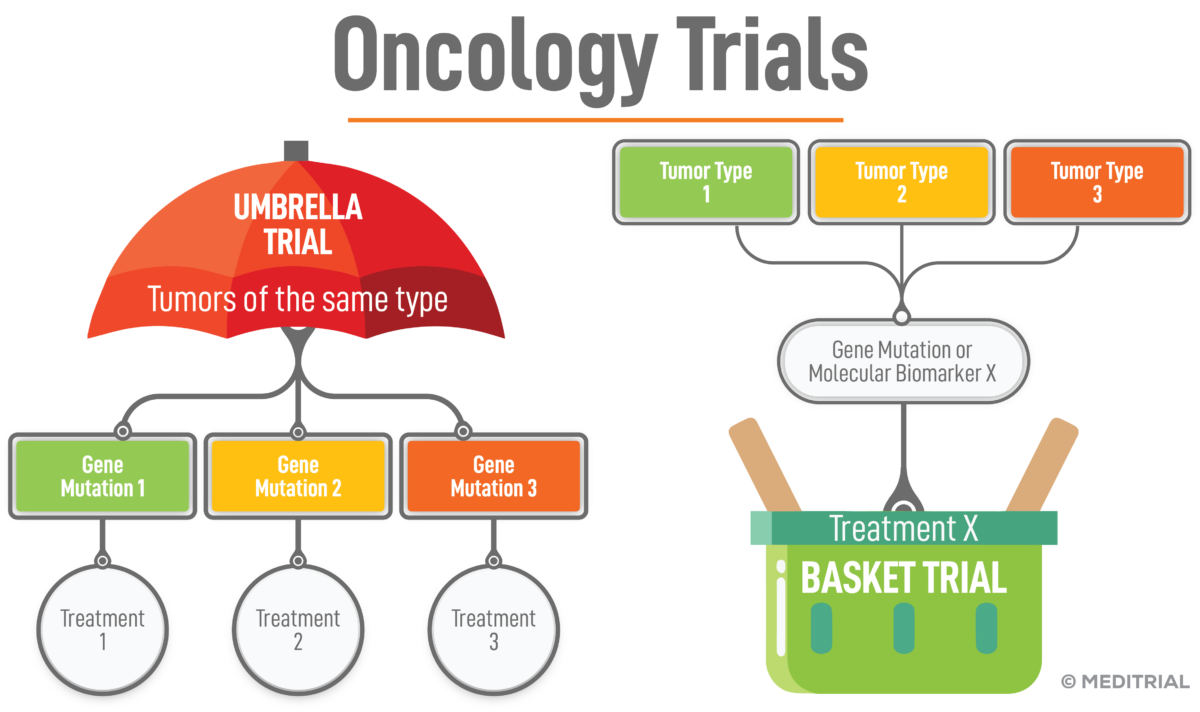
Un tipico disegno che include solo pazienti positivi ai biomarker sono i basket trial; queste sperimentazioni sono eseguite per verificare l’efficacia di un nuovo farmaco in pazienti con diverse tipologie di una malattia (es. malattia oncologica) ma che presentano tutti la stessa mutazione, biomarker positiva. Nei basket trial, i pazienti ricevono un trattamento mirato ad una specifica mutazione specifica, e non ad uno specifico tumore.
Un’altra possibilità è lo studio “ad ombrello”, in cui vengono valutate più terapie mirate a differenti mutazioni genetiche di una singola malattia (biomarker genetici). In questo tipo di studio i partecipanti sono stratificati in sottogruppi in base alle alterazioni genetiche.
BIOMARKER COME ENDPOINT SURROGATI
I biomarker possono essere utilizzati come endpoint surrogati negli studi clinici, sulla base del presupposto che vi sia una correlazione significativa tra il valore del biomarcatore, ed un determinato endpoint clinico di interesse. Il vantaggio dei biomarker è quello di poter determinare più rapidamente gli effetti del trattamento, rispetto all’endpoint clinico di interesse. Inoltre, in alcune circostanze non è possibile misurare le risposte cliniche direttamente; in questi casi, i biomarker forniscono un metodo alternativo per la valutazione della cura sperimentale.
Altri vantaggi indiretti dell’impiego di biomarker come end-point surrogati sono la riduzione delle dimensioni del campione del trial e consentire ai ricercatori di prendere decisioni in modo più rapido. In malattie con prognosi sfavorevole, vi sono vantaggi importanti dal punto di vista etico nell’utilizzo dei biomarker come endpoint surrogati.
Gli endpoint surrogati possono misurare la causa sottostante di una malattia o rappresentare un elemento che predice l’esito finale. Molte malattie, tuttavia, si manifestano con molteplici effetti fisiopatologici. In questo caso, l’utilizzo del biomarker può dare risultati dubbi e non risulta utile nel predire l’efficacia del trattamento.
Nel disegnare uno studio che include biomarker come endpoint per dimostrare il beneficio clinico di una terapia, è necessario verificare alcune condizioni.
- Esistono prove epidemiologiche affidabili e coerenti a sostegno del legame tra l’endpoint e il beneficio clinico?
- Quanto è forte la correlazione tra l’endpoint ed evento clinico?
- È stato dimostrato che il biomarker predice un beneficio clinico utilizzando un farmaco diverso che ha lo stesso meccanismo d’azione?
BIOMARKER IN ONCOLOGIA
I biomarker rappresentano la base fondamentale della moderna terapia oncologica. La ricerca ha dimostrato che i tumori hanno caratteristiche distinte, anche all’interno dello stesso tipo di cancro. I biomarcatori del cancro vengono ora utilizzati dai medici per saperne di più sul tumore di un paziente e prevedere quale trattamento ha più probabilità di funzionare contro ogni specifico tumore. I biomarcatori del cancro sono sostanze biologiche prodotte dal corpo o dal tumore di un malato di cancro. Il test dei biomarcatori aiuta a caratterizzare i cambiamenti del tumore.
I biomarcatori potrebbero essere profili di DNA, RNA, proteine o metabolomici specifici del tumore. Il test genomico esamina la sequenza del DNA. I biomarcatori possono essere utilizzati per una varietà di scopi, tra cui determinare il rischio di una persona di sviluppare il cancro, determinare la probabilità di una persona di recidiva del cancro, prevedere la probabilità che una terapia specifica sia efficace per un paziente specifico; e monitorare decorso di una malattia per vedere se un trattamento è efficace. Questi test sui biomarcatori sono tipicamente di natura genetica, alla ricerca di alterazioni nei geni che influenzano la progressione del cancro.
Sono in corso molti studi clinici in diverse aree di scoperta di biomarcatori. Oltre a identificare nuovi obiettivi e determinarne il significato, la nuova ricerca si concentra su diverse aree.
- Risposta all’immunoterapia: l’immunoterapia ha rivoluzionato il trattamento del cancro, ma non tutti i pazienti rispondono allo stesso modo. I ricercatori stanno identificando biomarcatori che predicono la risposta immunitaria per valutare quali pazienti traggono beneficio da quale tipo di immunoterapia.
- Biopsie liquide: le biopsie liquide possono rilevare il DNA rilasciato dai tumori, noto come DNA tumorale circolante. Un semplice prelievo di sangue può rivelare modifiche comuni del DNA per personalizzare le opzioni di trattamento; può anche valutare se il tumore sta rispondendo e indagare in che modo il tumore sviluppa resistenza a terapie specifiche sulla base di ulteriori variazioni genetiche scoperte in successivi esami del sangue.
- Malattia minima residua: questo tipo di biomarcatore può essere valutato attraverso il test della biopsia liquida dopo che la terapia è stata completata e non è presente alcuna malattia identificabile dopo l’esame e l’imaging. Attraverso l’analisi del sangue, la malattia residua minima valuta la malattia rimanente a livello molecolare. Potrebbe essere utilizzato per valutare quali pazienti trarrebbero beneficio da un trattamento più aggressivo e quali potrebbero essere risparmiati da tale trattamento.
- Marcatori farmacodinamici: utilizzano una biopsia prima e durante il trattamento per esaminare i cambiamenti molecolari dinamici all’interno del tumore e valutare se il medicinale sta funzionando come previsto.
LA RICERCA DI NUOVI BIOMARKER
La scoperta di nuovi biomarker è oggi considerata una la chiavi di volta nel futuro dello sviluppo clinico dei farmaci.
Un numero crescente di biomarker viene scoperto e identificato dalla ricerca preclinica, ma solo alcuni dei molti biomarker sperimentali, sono risultati utili dal punto di vista clinico. La validazione clinica di un biomarker viene stabilita autenticando la sua correlazione con l’esito clinico. Tale processo permette la valutazione delle prestazioni nonché la determinazione dell’intervallo di condizioni in cui il biomarker fornirà dati riproducibili e accurati.
I dati della ricerca clinica trasposti nella pratica clinica indicano come l’accuratezza nella validazione di un biomarker sia fondamentale per il beneficio del paziente. Un risultato falso positivo esporrà i pazienti a trattamenti non necessari e inefficaci, mentre un risultato falso negativo potrebbe comportate la sospensione di un trattamento potenzialmente efficace.
Nuove metodologie basate sulla genetica, metabolomica e proteomica permettono di avere a disposizione un consistente numero di nuovi biomarker. Il loro utilizzo nella ricerca clinica è una realtà in atto, mentre l’uso nella pratica clinica è ancora parziale. Per l’applicazione nella routine clinica, è necessario disporre di raccomandazioni scientifiche per ciascun biomarker, basate su robuste evidenze di correlazione e coerenza con gli eventi clinici nella patologia in esame.
RACCOMANDAZIONI PER LA RICERCA CLINICA
Nonostante i vantaggi, la strada dei trial clinici in associazione con i biomarker presenta alcune limitazioni. La prima riguarda la caratterizzazione della patologia in sottotipi talmente numerosi (es. in ambito oncologico) da rendere le stesse patologie “rare” e mettere dunque a rischio la fattibilità dello studio. Un secondo importante problema riguarda le specifiche intrinseche del biomarker e del target di trattamento. La mutevole dinamicità molecolare di entrambi variano nel tempo, in modo strettamente connesso con lo stadio e la tipologia della patologia e dei trattamenti. Per tali motivi, un paziente che oggi potrebbe essere categorizzato come “non responder” in base al biomarker, potrebbe diventare eleggibile nello studio in momenti successivi come conseguenza della variazione del profilo molecolare del biomarker e del suo target.
Il successo degli studi che utilizzano biomarkers come endpoint surrogati richiede una cooperazione multidisciplinare tra diversi settori, in cui le CRO con una expertise scientifica e regolatoria, come Meditrial, hanno un ruolo strategico nel definire e garantire endpoint scientificamente validi ed in linea con i requisiti richiesti dalle autorità regolatorie.
BIBLIOGRAFIA
Biomarker Rule-in or Rule-out in Patients With Acute Diseases for Validation of Acute Kidney Injury in the Emergency Department (BRAVA): A Multicenter Study Evaluating Urinary TIMP-2/IGFBP7. Yang HS, Antonini P et al; GREAT Network. Ann Lab Med. 2022 Mar 1;42(2):178-187. doi: 10.3343/alm.2022.42.2.178.
Metabolome-Defined Obesity and the Risk of Future Type 2 Diabetes and Mortality. Ottosson F, Antonini P et al. Diabetes Care. 2022 May 1;45(5):1260-1267. doi: 10.2337/dc21-2402.








Leave A Comment